Av: Erik Iversen
Anatomi
Overflaten av alle knokler er kledd med en fibrøs og nerverik hinne som kalles periost. Innenfor periost finnes to typer av beinvev; kortikalt- og trabekulært bein. Den ekstracellulære delen av bein, også kalt matrix, består av kollagenfibre og grunnsubstans. Orienteringen av kollagenfibrillene og krysslinkingen av disse er viktige faktorer som bestemmer hvor mye belastning beinet tåler. Den mineraliserte delen av matrix gir beinet styrke, hardhet og rigiditet.1
Andelen kortikalt og trabekulært bein varierer mellom individer og mellom ulike knokler. Diafysen til de lange rørknoklene er hovedsakelig kortikalt bein, mens endene og den sentrale delen av knokkelen domineres av trabekulært bein. Korte og flate knokler, som tarsal-beina og bekkenet, består av trabekulært bein omgitt av et tynnere lag kortikalt bein.1
Kortikalt bein er kompakt og sterkt, og utgjør nesten 80% av den totale skjelettmassen. Alle knokler i kroppen er omsluttet av kortikalt bein av varierende tykkelse. Grunnelementet i kortikalt bein er osteonet. Osteonene er sylinderformede strukturer som ligger tett inntil hverandre, og er organisert i beinets lengderetning. Disse danner til sammen det kortikale beinvevet. Hvert osteon er organisert rundt en sentral kanal, haversk kanal, som inneholder blodårer og nerver. Rundt denne kanalen ligger konsentriske lag, eller lameller, med mineralisert beinmatrix. I de enkelte lamellene går fibrene parallelt, men de har forskjellig retning i hver lamell. Dette gir en svært sterk struktur. Fordelt rundt på utsiden av lamellene finnes små hulrom som kalles lacunae. Hver av disse inneholder en enkelt osteocytt, eller beincelle. Osteocyttene har utløpere som kalles canaliculi slik at cellene har forbindelse med hverandre. Canaliculi er også en del av transportsystemet mellom osteocytten i lacuna og den haverske kanal hvor nærings- og metabolsk transport foregår.1 Det går transversale blodårer fra utsiden og inn i beinet med forbindelse til de haverske kanalene via Volkmann’s kanaler. Sammen danner dette systemet et intrakortikalt nettverk som også har forbindelse med periost og beinmargen. De ytre delene av korteks får næring fra periost, mens den indre delen av korteks får næring og blodforsyning fra beinmargssiden.1

Trabekulært bein består av trabekler formet som plater eller bjelker omgitt av beinmarg. Selve beinmargen utgjør mer enn 75% av det trabekulære beinvolumet. Trabekulært bein finnes hovedsakelig i det aksiale skjelettet innenfor den tynnere kortikale overflaten. Trabeklene er innrettet etter belastningen som beinet utsettes for. Dette gir en lett og sterk struktur. Trabekulært bein utgjør kun 20% av skjelettmassen, men har fire ganger høyere metabolsk aktivitet. Den metabolske funksjonen er derfor relativt likt fordelt mellom kortikalt og trabekulært bein. Det finnes ikke osteoner i trabeklene, og dermed heller ikke haverske kanaler eller Volkmann’s kanaler. Siden beinet ikke er kompakt kan blodkarene forløpe i beinmargen som fyller rommet mellom trabeklene. Trabekulært bein har en enklere oppbygning enn kortikalt bein. Trabeklene formes ved at osteoblaster i periferien (mot beinmargen) legger med matrix som ossifiseres. I denne prosessen blir noen av osteoblastene fanget i matrixen og blir til osteocytter. Trabeklene dannes dermed ved en konsentrisk deponering av bein i lameller oppå hverandre. Trabeklene er omsluttet av en endosteal hinne som danner en grense mot den omliggende beinmargen. Endosteum inneholder blant annet stamceller som kan differensiere til ulike typer celler ved behov. Selve beinmargen kan være rød marg som produserer blodceller, eller gul marg som er fett.
Bein har dermed fire områder hvor det kan legges til eller fjernes bein, periosteale, endokortikale, trabekulære og intrakortikale/haversianske.
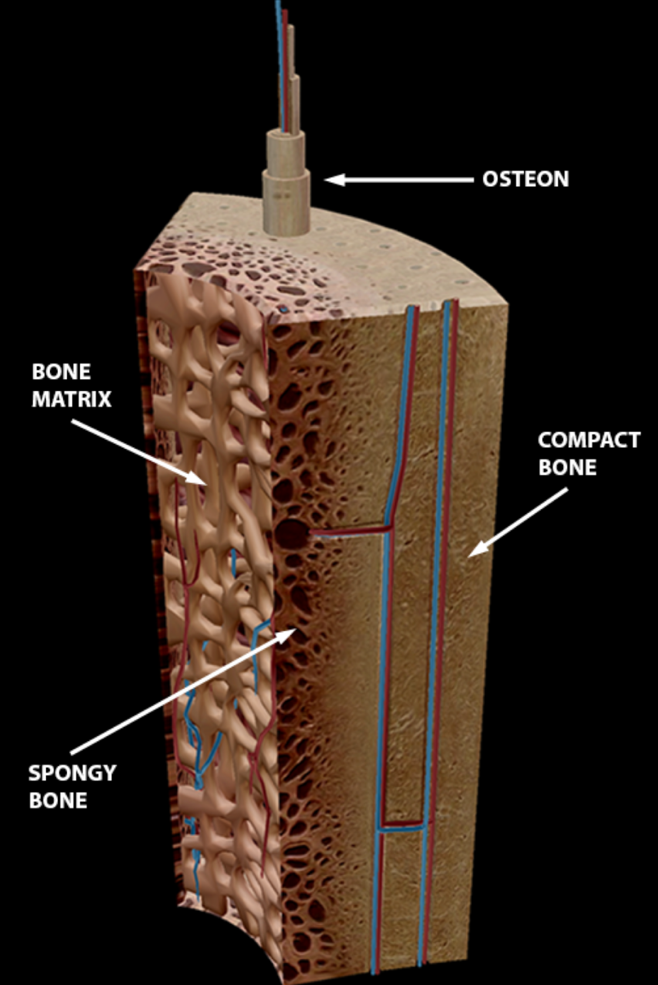
Fra: Human Anatomy Atlas
Beinets respons på belastning
Bein er et levende vev og tilpasser seg belastningene det utsettes for. Det er flere faktorer som påvirker turnover i bein, og disse inkluderer hormoner, cytokiner og mekanisk stimuli.
Mekanisk belastning påvirker bein-remodelleringen etter en U-formet kurve. Økt turnover i bein korresponderer med tap av beinmasse ved lav fysisk aktivitet. Høy mekanisk belastning øker både remodelleringen og beinformasjon fra periostsiden.2 Innen idrettsmedisin er det hovedsakelig i den høyre enden av skalaen vi ser problemer, men en må også ta hensyn til endringer i skjelettet etter langvarige avlastningsperioder når utøveren starter opp med belastende trening igjen.
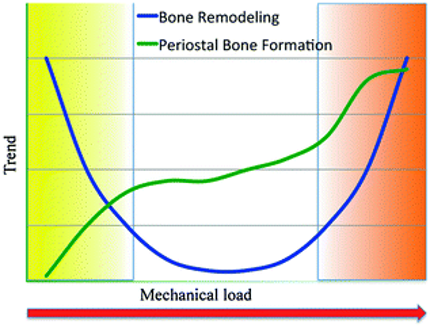
Fra: Robling et al2
Ved fysisk aktivitet i vektbærende stilling utsettes skjelettet både for direkte og indirekte krefter gjennom en kompleks kombinasjon av kompresjon, torsjon, bøyning og skjærkrefter. Uavhengig av om stresset kommer fra kontaktkraften mot bakken, fra muskeldrag, eller kombinasjonen av disse kreftene defineres dette som kraft per arealenhet i den belastede knokkelen. «Stress - strain» responsen til bein er avhengig av belastningsretning, beinets geometri, mikroarkitektur og beintetthet, samt påvirkningen fra omkringliggende muskulatur. Når en knokkel belastes, blir det utsatt for deformasjonskrefter. Når kraften fjernes, vil beinet returnere til sin opprinnelige form og posisjon dersom belastningen er innenfor beinets elastiske grense. Belastninger over den elastiske grensen fører beinet inn i den plastiske regionen der det vil oppstå irreversible forandringer og dannelse av mikrosprekker.1
Kortikalt bein har høyere elastisk modus enn trabekulært bein. Kortikalt bein har derfor stor evne til å motstå kompresjon, mens det er mer sensitivt for bøyingskrefter. Bøyningskrefter antas å være den viktigste faktoren for utvikling av en stressreaksjon i de lange knoklene. For trabekulært bein er det omvendt. Trabekulært bein har stor evne til å motstå bøyningskrefter med er mer sensitivt for kompresjon.1
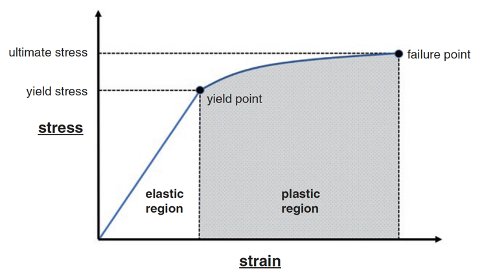 Fra: Lefere et al.1
Fra: Lefere et al.1
Dannelsen av mikrosprekker er sannsynligvis et resultat av gradvis reduksjon av stivhet som igjen er forårsaket av mikroskade på andre deler av matrix. Repeterte belastninger vil gi diffuse fokale regioner med et nettverk av ultra-strukturelle mikrosprekker på tensjonssiden av beinet, og lineære mikrosprekker interstitielt og intra-osteonalt på kompresjonssiden av beinet.3 Dersom beinet over tid utsettes for belastninger som overstiger beinets evne til reparasjon kan det oppstå en situasjon der beinet gradvis mister mer og mer stivhet. Dette kan resultere i videre utvikling av mikroskade som over tid kan utvikle seg til en stressreaksjon.
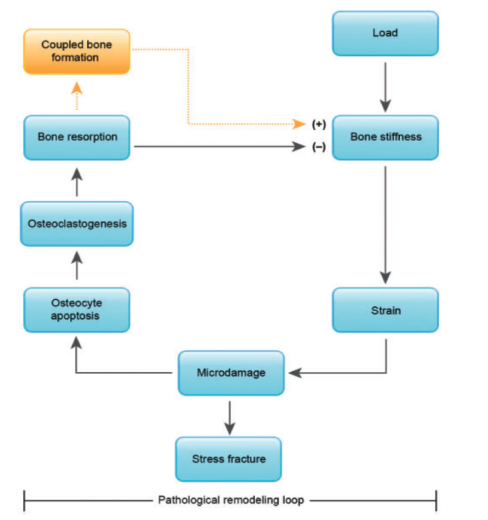
Den patologiske remodellerings-loopen. Fra: Hughes et al4
Remodelleringsprosessen
Det foregår en kontinuerlig reparasjon av beinvevet i kroppen der skadet og gammelt beinvev byttes ut med nytt bein. Dette kalles remodelleringsprosessen. Denne utføres av to ulike celletyper; Osteoklaster som resorberer bein, og osteoblaster som danner nytt bein.
Når det oppstår mikrosprekker i bein ødelegges canaliculi. Dette induserer osteocytt apoptose som igjen fører til aktivering av grupper av celler som lager midlertidige anatomiske strukturer. Disse kalles basic multicellular units (BMU). Intrakortikale BMUer opprettholder en distinkt tredimensjonal struktur som beveger seg i diafysens lengderetning.
I første rekke i BMUen kommer osteoklaster som resorberer bein. Osteoklastene lager et lukket miljø under cellen og resorberer bein ved å produsere en syre som løser opp mineralinnholdet i beinet. Det frigis deretter enzymer som fjerner den organiske matrixen.5 Maksimal beinresorpsjon skjer etter ca. 3 uker. Dette etterlater resorpsjonskaviteter der mikrosprekkene var, og dette fører til en midlertidig svekking av beinet.10
Etter den osteoklastiske resorpsjonen går beinet over i en reverseringsfase. En gruppe mononuklære celler kommer inn i området og ser ut til å glatte ut overflaten som en forberedelse til deponering av en reverseringslinje – et tynt lag med umineralisert matrix.
Til slutt kommer rekker av osteoblaster inn og binder seg til reverseringssonen. Osteoblastene skiller ut type 1 kollagenrik osteoid matrix som etter hvert blir mineralisert. Noen osteoblaster blir fanget i matrixen og blir omdannet til osteocytter.2,6,7 Størrelsen på remodelleringsområdet blir mindre etter hvert som flere og flere osteonale lameller legges ned og mineraliseres. Etter hvert stopper prosessen opp og etterlater seg en haversk kanal i midten av de nydannede osteonene.5 Det tar ca. 90 dager å fylle resorpsjonskavitetene med lamellært bein.8
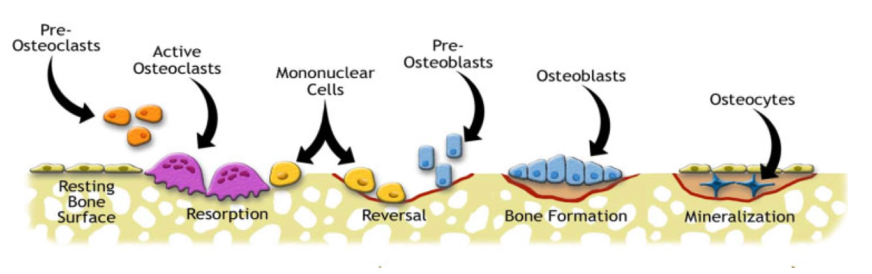
Remodellering av trabekulært bein følger samme prosess, men i stedet for å lage og fylle longitudinelle kanaler, fjernes og erstattes mer sirkulære områder i beinet.2
I trabekulært bein kan remodelleringen skape en reorientering av trabeklene for at beinet skal være bedre egnet til å tåle belastningene det utsettes for.1
Da deponering av nytt bein kommer etter dannelsen av resorpsjonskavitetene er beinet relativt svekket i denne perioden. Dersom belastningen fortsetter, vil osteoklastisk resorpsjon dominere. Dette vil føre til akkumulering av mikroskade og tilstanden vil kunne utvikle seg til en stressreaksjon.1
Hele remodelleringsprosessen kan ta fra 2-8 måneder. Tiden denne prosessen tar er blant annet avhengig av hvor mange BMUer som dannes. Dette kalles aktiveringsfrekvens. Høy aktiveringsfrekvens vil resultere i et stort antall aktive BMUer, som igjen fører til et stort antall sekundære osteoner.2
En annen faktor er hvor raskt BMUen beveger seg over vevet. Dette kalles Sigma perioden. Sigma perioden kvantifiserer antall dager det tar BMUen å gjøre en komplett remodellering av et spesifikt område i beinet. Sigma perioden deles inn i resorpsjon- og formasjonsperioder.2
Studier har vist at det vanligvis tar omtrent 120 dager for BMUen å resorbere bein og lage et nytt ferdig formet osteon i kortikalt bein. Resorpsjonen tar omtrent 20 dager, etterfulgt av 10 dager med reversering, og til slutt omtrent 90 dager med formasjon av nytt bein.2
Metabolske beinsykdommer manifesterer seg i en eller annen form for forstyrrelse i BMUens dynamikk, og mange sykdommer klassifiseres ut fra dens effekt på aktiverings frekvensen og sigma perioden.2
Beinbalanse
Måten BMUen fungerer på ved at osteoblastene følger etter osteoklastene, og at hele strukturen beveger seg som en anatomisk enhet, gjør at prosessen kalles «koblet». Det sørger for at det blir dannet nytt bein der bein har blitt resorbert, og totalt beinvolum og struktur forblir normalt relativt uendret.6 Den totale netto mengden av bein som fjernes og erstattes kalles beinbalansen. Koblingen i BMUen er sjeldent påvirket, men beinbalansen kan variere ved visse sykdommer og tilstander. Hos osteoporotiske pasienter er prosessen med resorpsjon og formasjon fortsatt koblet, men det er en negativ beinbalanse. Det vil si at det fjernes mer bein enn det som erstattes av BMUen. Ved avlastning øker også turnover i bein, og det oppstår en negativ beinbalanse. Resorpsjon av bein dominerer, og dette fører til raskt tap av beinmasse.2
I tillegg til remodellering skjer det også en modelleringsprosess i skjelettet. Modellering er assosiert med økning i beinmasse da osteoklastene resorberer mindre bein enn det som deponeres av osteoblastene. Dette er i kontrast til remodellering der det normalt er en balanse mellom resorpsjon og nydannelse av bein. Under modellering kan også osteoblastene og osteoklastene arbeide på forskjellige overflater. Osteoblastene legger da ned beinmatrix på den ytre periosteale overflaten, mens osteoklastene resorberer bein fra den indre endokortikale overflaten. Dette øker diameteren på knokkelen og dermed også styrken. Under modellering kan da de ulike cellene arbeide uten avbrudd. Beinmodellering er derfor en mye mer effektiv prosess enn remodellering for å endre form og masse på en knokkel. 9,10
Beinets respons på belastning via remodellerings- og modelleringsprosessene etterlater normalt et sterkere skjelett som er bedre rustet til å ta imot belastningene det utsettes for. Belastningen kan imidlertid bli for høy og overstige beinets evne til å reparere mikroskadene som oppstår. Dette kan da resultere i en stressreaksjon. Det ligger artikler som omhandler utredning og rehabilitering av de mest vanlige områdene for stressreaksjonene i underekstremiteten på Olympiatoppens nettsider.
Fremtidsvisjoner
Det kan tenkes at rehabiliteringen av stressreaksjoner i bein kan tilpasses bedre til remodelleringsprosessen. Det er anekdotiske bemerkninger rundt dette temaet blant annet fra Romani et al7 som foreslår sykluser med 2 uker belastning og en uke med lavere belastning som gjentas gjennom rehabiliteringen. Med mer kunnskap om belastningen som beinet utsettes for ved vektbærende aktivitet og hvordan denne eventuelt påvirker remodelleringsprosessen, kan sannsynligvis rehabiliteringen av disse skadene tilpasses enda bedre til den fysiologiske prosessen.
Referanser
1 Lefere, M., Demeyere, A. & Vanhoenacker, F. in Imaging of Orthopedic Sports Injuries (eds Filip M. Vanhoenacker, Mario Maas, & Jan L. M. A. Gielen) 135-150 (Springer International Publishing, 2021).
2 Robling, A. G., Castillo, A. B. & Turner, C. H. Biomechanical and molecular regulation of bone remodeling. Annual review of biomedical engineering 8, 455-498, doi:10.1146/annurev.bioeng.8.061505.095721 (2006).
3 Boyce, T. M., Fyhrie, D. P., Glotkowski, M. C., Radin, E. L. & Schaffler, M. B. Damage type and strain mode associations in human compact bone bending fatigue. Journal of orthopaedic research : official publication of the Orthopaedic Research Society 16, 322-329, doi:10.1002/jor.1100160308 (1998).
4 Hughes, J. M., Popp, K. L., Yanovich, R., Bouxsein, M. L. & Matheny, R. W., Jr. The role of adaptive bone formation in the etiology of stress fracture. Exp Biol Med (Maywood) 242, 897-906, doi:10.1177/1535370216661646 (2017).
5 Xiao, W., Wang, Y., Pacios, S., Li, S. & Graves, D. T. Cellular and Molecular Aspects of Bone Remodeling. Frontiers of oral biology 18, 9-16, doi:10.1159/000351895 (2016).
6 Kenkre, J. S. & Bassett, J. The bone remodelling cycle. Annals of clinical biochemistry 55, 308-327, doi:10.1177/0004563218759371 (2018).
7 Romani, W. A., Gieck, J. H., Perrin, D. H., Saliba, E. N. & Kahler, D. M. Mechanisms and management of stress fractures in physically active persons. Journal of athletic training 37, 306-314 (2002).
8 Campbell, S. E. & Fajardo, R. S. Imaging of stress injuries of the pelvis. Seminars in musculoskeletal radiology 12, 62-71, doi:10.1055/s-2008-1067938 (2008).
9 Rauch, F. Watching bone cells at work: what we can see from bone biopsies. Pediatr Nephrol 21, 457-462, doi:10.1007/s00467-006-0025-6 (2006).
10 Yusof, N. A., Soames, R. W., Cunningham, C. A. & Black, S. M. Growth of the human ilium: the anomalous sacroiliac junction. Anatomical record 296, 1688-1694, doi:10.1002/ar.22785 (2013).